Can we help you?
Contact us

Can we help you?
Contact us

Thank you for contacting us
Your form has been submitted successfully Our team will contact you again as soon as possible.
Whooppss...!! An error has occurred
Try sending later or write an email directly to areaempresas@ua.es

INFO
SHEET
DOWNLOAD
EXECUTIVE
ABSTRACT
CONTACT DETAILS:
Relaciones con la Empresa
Oficina de Transferencia de Resultados de la Investigación-OTRI
Universidad de Alicante
Tel.: +34 96 590 99 59
Email: areaempresas@ua.es
http://innoua.ua.es
El grupo Electroquímica Aplicada y Electrocatálisis ha desarrollado una novedosa tecnología que permite modificar selectivamente cualquier biomolécula (enzimas, proteínas redox, lipoproteínas, anticuerpos, etc.), tanto por métodos electroquímicos (por ejemplo, nitración, cloración, bromación, y iodación en residuos de aminoácidos de tirosina, u oxidación de metionina), como por métodos químicos clásicos.
Entre las principales ventajas del uso del método electroquímico, destaca por ser muy selectivo y específico, las condiciones de reacción son muy suaves, proporciona modificaciones totalmente controlables, se mantiene la actividad y la estructura respecto a la proteína nativa y son mínimos o no aparecen subproductos.
Tiene aplicaciones en la inmovilización de biomoléculas, como biosensores, biomarcadores, en la síntesis de nuevos anticuerpos monoclonales y nuevos modelos de proteínas para el estudio de ciertas enfermedades patofisiológicas (neurodegenerativas y cardiovasculares), así como en modificaciones post-traslacionales en estudios de Proteómica.

El grupo de Electroquímica Aplicada y Electrocatálisis de la Universidad de Alicante posee una gran experiencia y habilidad en la modificación selectiva de cualquier tipo de biomolécula (enzimas, proteínas redox, lipoproteínas, anticuerpos, etc.), tanto por métodos electroquímicos, como por métodos químicos clásicos.
Entre los actuales métodos para modificar proteínas, cabe destacar:
+ Ingeniería de proteínas.
+ Modificación química de los residuos de metionina, tirosina y lisina.
+ Tratamiento con aldehídos
+ Aplicación de radiación electromagnética.
+ Fotooxidación.
+ Oxidación electroquímica (directa o indirecta):
- Nitración.
- Cloración.
- Oxidación de metionina.
- Iodación.
- Bromación.
La Ingeniería de proteínas es una metodología que permite la producción de proteínas modificadas en cantidades sustanciales. Así, es posible reemplazar, por ejemplo, residuos específicos de tirosina en una cadena polipeptídica por, quizás, unidades de fenilalanina; pero no es posible usarla para crear residuos de nitrotirosina en la cadena.
Respecto a la modificación química (con tetranitrometano, por ejemplo), ésta permite la formación de unidades de nitrotirosina; sin embargo, el reactivo es desagradable y tóxico, además, no es particularmente selectivo si hay más de un residuo de tirosina que puede ser nitrado y, una vez que la reacción ha tenido lugar, es necesario separar el reactivo que no ha reaccionado (esto puede ser difícil, especialmente cuando hay implicadas delicadas especies bioactivas), eliminar los subproductos, y finalmente separar y purificar los productos.
Con el objetivo de superar todos estos obstáculos, el grupo de investigación ha desarrollado una novedosa metodología de síntesis electroorgánica que permite la modificación selectiva de biomoléculas. Entre sus principales ventajas, se caracteriza por mantener a la proteína en condiciones más suaves de reacción, ya que la energía procede de la aplicación de un potencial a un electrodo y no de la reactividad de un agresivo agente químico; además, no hay subproductos derivados de la presencia de reactivos químicos, por lo que no resulta necesario efectuar ninguna separación adicional. Finalmente, la reacción se puede parar inmediatamente mediante el cese de la corriente, sin necesidad de añadir sustancias que neutralicen los reactivos iniciales.
Consecuentemente, la modificación electrosintética de proteínas y otras especies bioactivas es un nuevo método para la producción de nuevas funcionalidades en residuos de aminoácidos específicos (tirosina, metionina, triptófano, lisina, etc.) mediante nitración, cloración, oxidación de grupos sulfuro, iodación o bromación de varias proteínas modelo, tales como lisozima, mioglobina, citocromo c, anticuerpos, así como lipoproteínas de baja densidad (LDL), consiguiendo gran especificidad, selectividad y control de la oxidación. No obstante, el grupo también tiene capacidad para llevar a cabo modificaciones químicas convencionales (nitración, cloración y oxidación utilizando, por ejemplo, peroxinitrito o tetranitrometano, ácido hipocloroso, ácido hipobromoso, peróxido de hidrógeno, triioduro, etc.) en proteínas o lípidos.
Técnicamente, es posible llevar a cabo la modificación electroquímica selectiva utilizando electrodos carbonáceos, como por ejemplo un electrodo de diamante dopado con boro (BDD), ya que es uno de los materiales que permite una retención de la actividad y la estructura de la proteína igual o similar a la proteína nativa, sin contribuciones no deseadas atribuidas a las interacciones electrodo-proteína que sí aportan otros electrodos, por ejemplo, el de platino. Además, la estabilidad física, química y electroquímica de los electrodos carbonáceos y en concreto el BDD los hacen especialmente interesantes en el tratamiento de aguas residuales, electroanálisis y, por supuesto, en la química de proteínas y DNA.
La modificación electroquímica de proteínas tiene lugar en una celda electroquímica según el siguiente esquema:
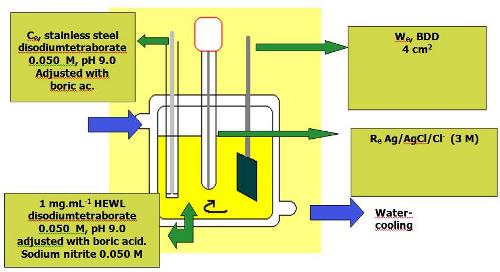
Se han encontrado proteínas nitradas en residuos de tirosina en un amplio rango de enfermedades: cardiovasculares, diabetes, ateroesclerosis, rechazo a órganos transplantados, neurodegenerativas (Alzheimer, Parkinson, Creutzfeldt-Jakob, esclerosis múltiple), etc.
Particularmente, la oxidación de algunas proteínas, tales como las lipoproteínas de baja densidad (LDL), juega un papel crucial en el desarrollo de enfermedades vasculares: arterosclerosis, infarto de miocardio y apoplejía. El nivel de oxidación de las LDL puede ser un biomarcador de la presencia, severidad y desarrollo de la enfermedad. Los agentes oxidantes más comunes son el peroxinitrito (ONOO-) y el ácido hipocloroso (HOCl). Ambos son producidos por las células endoteliales, neutrófilos y macrófagos. El ácido hipocloroso se forma a partir de peróxido de hidrógeno y cloro en una reacción catalizada por la enzima mieloperoxidasa. El peroxinitrito, que se forma por una reacción rápida entre el ion superóxido (¿O2-) y el óxido nítrico (NO¿), es liposoluble y similar en reactividad al ácido hipocloroso. Es un potente agente de nitración y de oxidación de biomoléculas, entre las que destacan las proteínas y los lípidos. Las dianas de estos efectos son los residuos de cisteína, metionina y triptófano en proteínas, dando lugar, además, a funciones carbonil y ruptura inespecífica. Sin embargo, la principal diana son los residuos de tirosina, hidroxilándose, dimerizando o más frecuentemente, nitrándose. El producto final es la 3-nitrotirosina, tanto libre como formando parte de proteínas. Esto hace que se pueda considerar como un biomarcador de la producción de peroxinitrito.
Las LDL pueden pasar por diferentes estados de oxidación, teniendo diversos efectos en la ateroesclerosis. Estudiando los mecanismos de oxidación de las LDL se pueden plantear estrategias en el tratamiento de la enfermedad. Dilucidar el mecanismo de oxidación in vivo es muy difícil, pues diversos intermediarios de la reacción que promueven la oxidación de las LDL, como el oxido nitroso, tienen vidas medias muy breves y son difíciles de detectar. El uso de una metodología electrosintética es una estrategia alternativa para conseguir especificidad, selectividad y control en la oxidación de las LDL, determinando el papel de las posibles dianas (lípidos y proteínas) pudiendo finalmente relacionar el estado de gravedad de la enfermedad y el grado de oxidación de las LDL.
Por otro lado, los sensores electroquímicos destacan por ser una tecnología importante para detectar biomoléculas en fluidos biológicos, como por ejemplo colesterol en LDL. El desarrollo de un bioelectrodo con este fin implica la inmovilización de la colesterol oxidasa (ChOx), bien sea sobre un electrodo modificado mediante monocapas autodepositadas (SAMs), o bien sobre electrodos modificados con polímeros conductores. En cualquier caso, el primer paso en el desarrollo de un bioelectrodo es la electronitración de la colesterol oxidasa. Por tanto, resulta fundamental un método de modificación selectiva que no suponga una pérdida de actividad enzimática y que, al mismo tiempo, permita una unión específica con el SAM o los polímeros conductores unidos previamente al electrodo. En definitiva, la metodología desarrollada por el grupo de investigación hace factible este desarrollo tecnológico.
Además, el grupo tiene los conocimientos técnicos y la infraestructura necesaria (Servicios Técnicos de Investigación de la Universidad de Alicante) para llevar a cabo estudios de Espectroscopía UV-Vis, Espectrometría de Masas (MALDI-TOF y ESI-FTICR), Resonancia Magnética Nuclear de Alto Campo, Fluorescencia y Dicroísmo Circular entre otros, para conocer con exactitud los cambios conformacionales, el grado de modificación, la selectividad y la especificidad, y correlacionar así las consecuencias estructurales y funcionales derivadas del tratamiento electroquímico o químico como primer paso para entender cómo se produce el progreso de las enfermedades con disfunciones patofisiológicas.

Figura 2. Espectrómetro de RMN de 500 MHz (BRUKER AVANCE DRX500) de los Servicios Técnicos de Investigación de la Universidad de Alicante
INGENIERÍA DE PROTEÍNAS
- Requiere instalaciones caras
- Metodología muy sofisticada
- Restringido a determinados aminoácidos naturales
MODIFICACIÓN QUÍMICA
- Falta de especificidad
- Reacciones secundarias
- Condiciones químicas agresivas
- Toxicidad de los reactivos
- La separación y purificación puede ser compleja
- Requiere eliminar el exceso de reactivo inicial
VENTAJAS DE LA MODIFICACIÓN ELECTROQUÍMICA DE BIOMOLÉCULAS
- Proporciona selectividad
- Especificidad
- Condiciones muy suaves de reacción
- Reducciones/oxidaciones totalmente controlables
- Retiene la actividad y la estructura respecto a la proteína nativa
- No aparecen subproductos
- No son necesarios pasos extras de separación y/o purificación
- Cese de la reacción por el simple corte de la corriente eléctrica
ASPECTOS INNOVADORES
La aplicación de técnicas electroquímicas (nitración, cloración, bromación, iodación, oxidación de metionina, etc.) para la modificación selectiva de biomoléculas, tiene consecuencias estructurales y funcionales sobre dichas proteínas. De este modo, es posible obtener novedosas aplicaciones tales como la obtención de sensores bioelectroquímicos, inmovilización de proteínas, biomarcadores, obtención de nuevos anticuerpos monoclonales con innumerables usos, modificaciones selectivas post-traslacionales en el campo de la Proteómica, etc.
Además, el grupo de investigación posee un gran dominio en el uso de técnicas analíticas tales como la Espectrometría de Masas (MALDI-TOF y ESI-FTICR) o la Resonancia Magnética Nuclear de Alto Campo entre otras, pudiendo de esta forma relacionar el progreso de muchas enfermedades patofisiológicas con las modificaciones de residuos de aminoácidos llevadas a cabo.
· Inmovilización de biomoléculas (enzimas, proteínas, anticuerpos, etc.): por ejemplo, es posible aprovechar la nitración selectiva de tirosinas seguida de la reducción del grupo nitro- a amino-, para conseguir un lugar específico de inmovilización a pH 5 (a diferencia de utilizar lisina para la inmovilización, ya que ésta tiene un pKa>8).
· Sensores bioelectroquímicos o biosensores: la modificación de anticuerpos permite un amplio abanico de aplicaciones potenciales en inmunoensayos.
· Biomarcadores: es posible obtener péptidos o proteínas marcadas radiactivamente de un modo muy selectivo (por ejemplo, tirosina con 125I), para hacer un adecuado seguimiento.
· Modificación de anticuerpos monoclonales según la demanda del cliente: para aumentar su inmovilización en diferentes soportes, marcaje, medir su actividad, formas de reutilización de los anticuerpos para abaratar costes, etc.
· Metabolómica: síntesis de nuevos modelos de proteínas implicadas en enfermedades que impliquen disfunciones patofisiológicas para entender mejor cómo se produce el progreso de la enfermedad, por ejemplo: neurodegenerativas (Alzheimer, Parkinson, Creutzfeldt-Jakob, esclerosis múltiple), diabetes, arterosclerosis, rechazo de órganos transplantados, etc.
· Proteómica: modificaciones post-traslacionales selectivas de proteínas, así como la aplicación de diversas técnicas de reconocimiento: SDS-Page, HPLC Y LPLC, Espectrometría de Masas, Resonancia Magnética Nuclear (estudios conformacionales), Dicroísmo Circular, Espectroscopía UV-Vis y fluorescencia
· Contactar con empresas u otras entidades interesadas en el desarrollo específico de nuevos biosensores para diversos usos (clínico, forense, control de calidad agronómico o enológico, etc.), biomarcadores, inmovilización de biomoléculas, modificación de anticuerpos monoclonales, síntesis de nuevos modelos proteicos·
· Establecer proyectos de I+D+i con organismos de investigación (públicos o privados), con el objetivo de abrir nuevas líneas de investigación en el campo de la Bioelectroquímica
· Impartir cursos de formación respecto al uso de las novedosas técnicas electroquímicas de modificación selectiva aplicadas a distintas biomoléculas.
Biology
Molecular Biology and Biotechnology
Pharmacology, Cosmetics and Ophthalmology
Medicine and Health
Chemical Technology
Carretera San Vicente del Raspeig s/n - 03690 San Vicente del Raspeig - Alicante
Tel.: (+34) 965 90 9959




