Necessites ajuda?
Posa't en contacte amb nosaltres

Necessites ajuda?
Posa't en contacte amb nosaltres

Gràcies per contactar
El teu formulari s'ha enviat correctament. El nostre equip es posarà de nou en contacte amb tu com més prompte millor.
Upppss...!! Ha ocorregut un error.
Intente l'enviament més tard o escriga un correu electrònic directament a areaempresas@ua.es

LA FITXA
COMPLETA
BAIXA
RESUM
EXECUTIU
DADES DE CONTACTE:
Relaciones con la Empresa
Oficina de Transferencia de Resultados de la Investigación-OTRI
Universidad de Alicante
Tel.: +34 96 590 99 59
Email: areaempresas@ua.es
http://innoua.ua.es
El grupo de investigación “Microbiología Molecular” de la Universidad de Alicante ha descrito una nueva endonucleasa Cas12a, denominada AlCas12a, derivada de un metagenoma de aguas residuales. Esta proteína es más pequeña que las variantes habituales y reconoce un PAM de solo dos nucleótidos, lo que amplía el número de secuencias diana y facilita su administración a células.
AlCas12a corta tanto en cis (en secuencias específicas de ADN bicatenario) como en trans (degradando cualquier ADN monocatenario). Esta dualidad la convierte en una herramienta muy versátil para edición genética precisa, regulación epigenética, selección de mutantes, diagnóstico molecular de enfermedades y patógenos, y producción de agentes antimicrobianos. Su uso en bacterias confiere resistencia a virus con secuencias diana concretas o sin ellas, permitiendo su uso como antimicrobiano frente a bacterias resistentes a antibióticos.
Se buscan empresas interesadas en adquirir la tecnología para su explotación comercial mediante acuerdos de licencia de la patente.

Los sistemas CRISPR-Cas son mecanismos de defensa adaptativa que las bacterias y arqueas utilizan para reconocer y degradar material genético invasor, como plásmidos y virus. En estos sistemas, una secuencia de ADN llamada CRISPR (del inglés Clustered Regularly Interspaced Short Palindromic Repeats), compuesta por repeticiones y espaciadores, se transcribe y procesa en moléculas de ARN-guía (crRNAs). Estos ARNs se unen a una proteína Cas, que actúa como endonucleasa y corta el ADN diana complementario. Entre las variantes de la familia Cas, la Cas12a ha destacado por su capacidad de generar cortes de cadena doble, lo que la hace útil en diferentes aplicaciones biotecnológicas.
Sin embargo, el uso de Cas12a presenta dos limitaciones significativas:
1) La necesidad de un motivo PAM (del inglés Protospacer Adjacent Motif) que restringe la cantidad de secuencias diana disponibles: la mayoría de las Cas12a reconocen PAMs con secuencias de 3-4 nucleótidos, lo que limita la flexibilidad del sistema.
2) Las proteínas Cas12a típicas son de gran tamaño (entre 1200-1400 aminoácidos), lo que dificulta su administración a células, tanto en organismos procariotas como eucariotas, y complica la construcción de vectores de expresión eficientes.
Además, aunque se ha observado que algunas Cas12a pueden cortar ADN sin necesidad de ARN guía, esta actividad no se ha demostrado en vivo, ni se ha evaluado su contribución a la inmunidad bacteriana. Este desconocimiento limita la explotación de la actividad indiscriminada de estas proteínas para diferentes aplicaciones biomédicas.
La presente invención propone una nueva proteína Cas12a, denominada AlCas12a, que combina un tamaño reducido con un motivo PAM mínimo. Esta combinación permite una mayor versatilidad en la selección de dianas y facilita la administración de la proteína a células mediante vectores comunes, como plásmidos, bacteriófagos, lentivirus o virus adenoasociados. AlCas12a mantiene la capacidad de corte dirigido y de degradación indiscriminada de ADN de cadena sencilla, abriendo la puerta a aplicaciones en edición genética, diagnóstico de enfermedades y desarrollo de antibacterianos específicos de secuencia. Con esta tecnología, se mejora la restricción de PAM y el problema del tamaño, ofreciendo una herramienta más flexible para ingeniería genética y biotecnología.
En la última década, el sistema CRISPR-Cas se ha convertido en la herramienta más versátil para la edición genética, permitiendo a los científicos “cortar” y “reemplazar” secuencias de ADN con una precisión sin precedentes. La presente invención describe una nueva variante de la proteína Cas12a, denominada AlCas12a (véase Figura 1) que promete superar dos de las limitaciones más habituales de sus predecesoras: su gran tamaño y la necesidad de un motivo PAM (Protospacer Adjacent Motif) muy restrictivo.
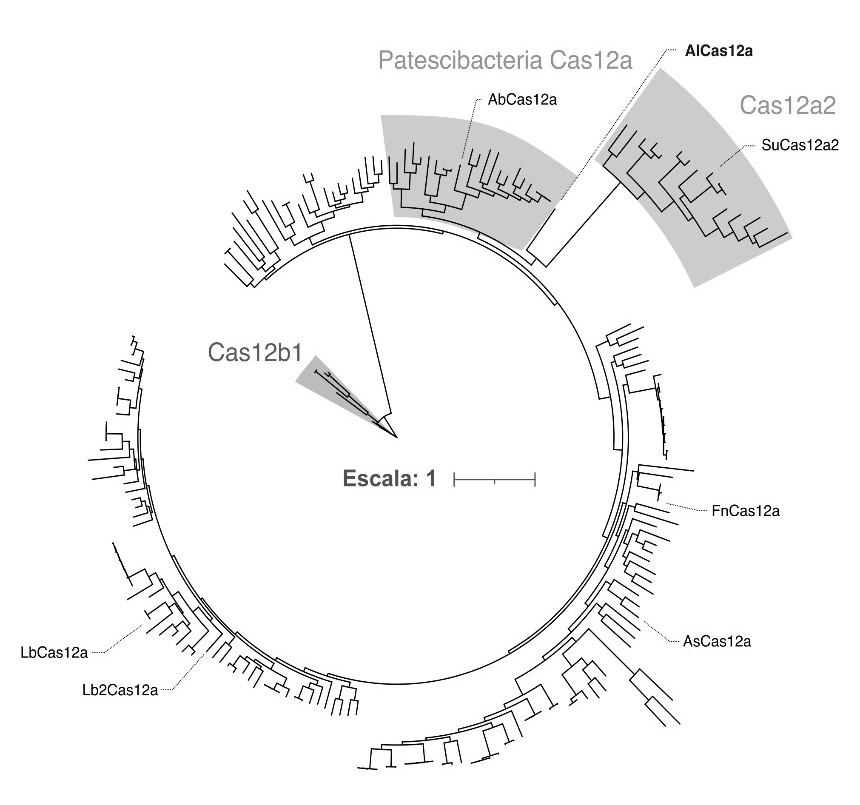
Figura 1: relaciones filogenéticas entre proteínas Cas12 mediante un árbol filogenético de AlCas12a, proteínas asignadas a la familia Cas12a, incluyendo ortólogos de Patescibacteria (sombreado), miembros del grupo Cas12a (sombreado) y ortólogos de la familia Cas12b1 (sombreado).
AlCas12a (véase Figura 2) proviene de un metagenoma de aguas residuales, un entorno rico en bacterias que a menudo poseen sistemas de defensa CRISPR poco estudiados. Esta proteína contiene 1226 aminoácidos, un 20% menor que la versión más común de Cas12a (alrededor de 1400 aminoácidos). Este tamaño reducido facilita su introducción en vectores de clonación y su expresión en células, tanto procariotas como eucariotas.

Figura 2: representación esquemática del cóntigo donde se localiza el locus CRISPR-alcas12a.
El motivo PAM que reconoce AlCas12a es TTN (dos timinas seguidas de cualquier nucleótido), uno de los más permisivos entre las Cas12a conocidas. En la práctica, esto significa que la enzima puede dirigirse a un número mucho mayor de secuencias diana dentro del genoma, ampliando el espectro de posibilidades.
La presente invención describe experimentos in vivo, concretamente en la bacteria Escherichia coli, que confirmaron la preferencia por TTN y la validación de su uso en edición genética, así como ensayos bioquímicos in vitro que permitirieron caracterizar las distintas actividades y requerimientos de la proteína AlCas12a.
Una característica sorprendente de AlCas12a es la ausencia de actividad ribonucleasa. La mayoría de las Cas12a procesan el ARN precursor (pre-crRNA) en ARN-guías maduros que luego se unen a la enzima. AlCas12a, sin embargo, no muestra esta capacidad, lo que abre la posibilidad de usar ARN-guía sintéticos con modificaciones que normalmente serían degradadas por la propia enzima.
En cuanto a su función de corte, AlCas12a actúa de tres maneras distintas:
1. Corte específico (en cis): la proteína reconoce la secuencia diana con su crRNA guía y corta ambas hebras de ADN, generando extremos sobresalientes de una sola hebra. Los ensayos in vitro con fragmentos de 840 pb demostraron un 94 % de corte en 15 min a 37 °C, y que la temperatura óptima se sitúa entre 35 °C y 40 °C (véase Figura 3), lo que la hace adecuada para la mayor parte de seres vivos.
2. Corte inespecífico dependiente de guía (en trans): una vez activada por la unión a su diana, AlCas12a puede degradar cualquier molécula de ADN de cadena sencilla (ADNcs) (véase Figura 3: imágenes A y D). Este comportamiento, similar al de otras Cas12a, se ha aprovechado para la detección de nucleótidos en diagnóstico molecular.
3. Corte inespecífico independiente de guía: requiere una cadena sencilla de ADN (véase Figura 3: imágenes B, C y D).
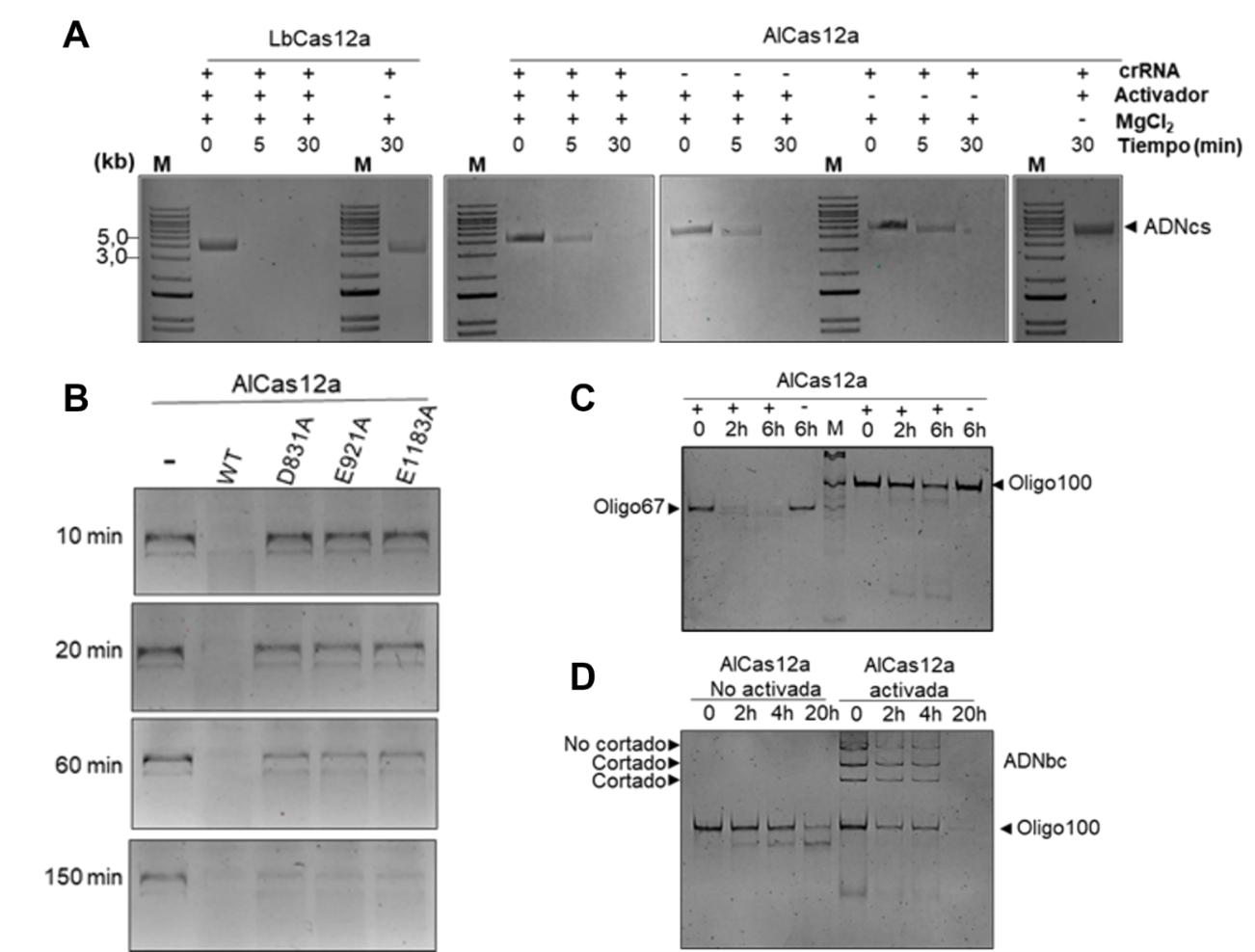
Figura 3: varios ejemplos de los resultados de electroforesis en gel de agarosa de muestras de ensayos in vitro de escisión de ADNbc por AlCas12a en diferentes condiciones de reacción.
En experimentos con bacterias que expresan AlCas12a se observó una reducción significativa de la susceptibilidad a virus de ADN de cadena sencilla (M13) y de doble hebra (P1), incluso cuando la enzima no estaba dirigida a una secuencia específica (véase Figura 4).
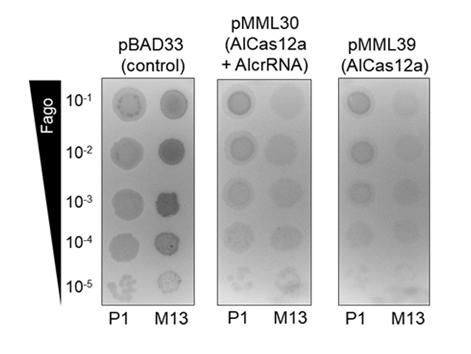
Figura 4: halos de inhibición del crecimiento de cultivos de E. coli incubados durante 16 horas a 37 ºC en placas tras depositar en su superficie gotas de diluciones decimales de una suspensión del fago de ADNcs M13mp18 (M13) o del fago de ADNbc P1-vir (P1).
Para demostrar su utilidad práctica en edición genética, los autores diseñaron un sistema de edición en E. coli que combina AlCas12a con un crRNA dirigido al gen pyrF. La presencia de la enzima y el crRNA provocó la eliminación de 607 pb en el genoma con una frecuencia de 90%, lo que confirma la potencia de la herramienta para seleccionar mutantes. Además, se desarrolló una variante “inactiva” (dAlCas12a) mediante mutaciones en los residuos catalíticos D831A, E921A y D1183A (véase Figura 3: imagen F). Estas versiones sin actividad de corte pueden fusionarse con dominios proteicos con distintas actividades.
En resumen, AlCas12a representa un avance significativo en la ingeniería genética, ofreciendo una enzima más pequeña y más flexible.
VENTAJAS DE LA TECNOLOGÍA
Esta novedosa tecnología aporta las siguientes ventajas:
1. El tamaño reducido de la proteína AlCas12a (1226 aminoácidos) facilita la administración mediante vectores plasmídicos y virales.
2. El reconocimiento de PAM flexible (nucleótidos 5’-TTN-3’) amplía el número de sitios editables.
3. La actividad de corte en trans posibilita la creación de sistemas de diagnóstico molecular.
4. El rango operativo de temperatura (entre 20-45 °C) permite su aplicación en una gran diversidad de organismos, incluyendo plantas y animales (tanto ectotermos, como endotermos).
5. Permite la defensa universal contra ADN invasor sin necesidad de crRNA, protegiendo a las bacterias de virus de ADN, independientemente de su secuencia.
6. Los mutantes “dead” AlCas12a sin actividad de corte se pueden utilizar como reguladores de expresión, entre otras muchas aplicaciones.
7. Potencial como antibacteriano específico de secuencia, ofreciendo una alternativa a los antibióticos.
8. Tienen el potencial de permitir el silenciamiento o la eliminación de genes, mutagénesis y correcciones de secuencias específicas del genoma de cualquier célula de una manera fácil, rápida y altamente precisa.
9. La incapacidad de AlCas12a para procesar los ARN-guía permite utilizar guías optimizadas con secuencias modificadas sin el riesgo de que éstas sean alteradas por la proteína efectora.
ASPECTOS INNOVADORES DE LA TECNOLOGÍA
AlCas12a es más pequeña que la mayoría de las variantes comerciales y es capaz de reconocer un patrón de ADN (PAM) muy sencillo (5’-TTN-3’), lo que amplía el rango de dianas editables y facilita su administración a células.
AlCas12a mantiene la actividad de corte en cis y en trans, además de una potente degradación de ADN de cadena sencilla sin guía, lo que la convierte en una herramienta versátil para edición genética, diagnóstico de enfermedades y producción de antibacterianos específicos. También carece de actividad ribonucleasa, permitiendo usar crRNAs modificados sin alterar su secuencia.
Se ha identificado y codificado una nueva endonucleasa (AlCas12a) de tamaño reducido que se expresa de forma estable en E. coli y que se purifica mediante una etiqueta de Histidina sin comprometer su actividad.
Los ensayos in vitro de digestión (corte en cis) han demostrado que la enzima reconoce un motivo PAM muy permisivo de solo dos nucleótidos (5′-TTN-3′), lo que amplía el rango de posibles dianas.
La ausencia de actividad ribonucleasa permite el uso de crRNAs con secuencias modificadas.
Se ha confirmado la actividad de corte en trans y la capacidad de degradar ADN de cadena sencilla de forma independiente de guía, lo que abre aplicaciones en diagnóstico y en defensa innata contra virus bacterianos.
Además, la enzima ha sido empleada con éxito para la edición del genoma de E.coli, facilitando la selección de células editadas.
Actualmente, la tecnología se encuentra en fase de validación experimental (TRL 4), respaldada por experimentos de laboratorio y pruebas celulares que demuestran su funcionalidad y potencial en edición genética, diagnóstico y desarrollo de antibacterianos. El diseño incorpora facilidades de transporte, manipulación y administración a células, lo que la posiciona como una plataforma lista para pruebas piloto en biotecnología, biomedicina y agricultura.
La patente describe usos que van desde la edición genética en plantas y animales, el desarrollo de bacterias resistentes a virus y la detección rápida de patógenos. La combinación de un tamaño compacto, un PAM permisivo y la ausencia de actividad ribonucleasa posiciona a AlCas12a como una herramienta versátil que puede adaptarse a las necesidades de investigación y biotecnología con mayor facilidad que las versiones actuales de Cas12a.
Entre los principales campos de aplicación, destacan los siguientes: Biología, Biotecnología, Biomedicina y Agroalimentación, siendo los siguientes usos los más importantes:
• Edición genética.
• Producción de antibactarianos.
• Degradación inespecífica de secuencias de ADN de cadena sencilla.
• Selección de mutantes.
• Diagnóstico molecular.
• Regulación de la expresión génica.
• Modificación epigenética.
Su potencial para la edición precisa, la detección de secuencias específicas y la protección contra infecciones bacterianas, especialmente cuando la bacteria presenta resistencia a antibióticos, abre nuevas vías para la investigación básica y la aplicación clínica, consolidando el papel de los sistemas CRISPR-Cas como pilares de la biología moderna.
Se buscan empresas interesadas en adquirir esta tecnología para su explotación comercial mediante acuerdos de licencia de la patente.
Perfil de empresa buscado:
• Empresas de edición genética.
• Laboratorios de diagnóstico molecular.
• Fabricantes de antibacterianos y agentes antimicrobianos.
• Empresas farmacéuticas y de biomedicina.
• Compañías de vectores de administración genética.
• Instituciones de investigación y universidades con programas de biología sintética y microbiología.
• Start-ups de biotecnología enfocadas en soluciones de control de infecciones y resistencia bacteriana.
La presente invención se encuentra protegida mediante solicitud de patente:
• Título de la patente: “Proteína endonucleasa Cas12a y sistema CRISPR-Cas12a asociado”.
• Número de solicitud: P202530287.
• Fecha de solicitud: 7 de abril de 2025.
Biología Molecular y Biotecnología
Farmacéutica, Cosmética y Oftalmológica
Medicina y Salud
Carretera de Sant Vicent del Raspeig s/n - 03690 Sant Vicent del Raspeig - Alacant
Tel.: 965 90 9959




